– Christian Hoffmann –
HIV-Patienten haben ein erhöhtes Krebsrisiko. Dies gilt nicht nur für die drei AIDS-definierenden Malignome (ADM) Kaposi-Sarkom, Non-Hodgkin-Lymphom und Zervixkarzinom. Auch bei vielen Nicht-AIDS-definierenden Malignomen (Non-ADM) ist eine erhöhte Inzidenz zu beobachten. Das Risiko für Non-ADM insgesamt ist für HIV-Patienten etwa 2-3-fach gegenüber der nicht infizierten Bevölkerung erhöht (Frisch 2001, Franceschi 2010).
Bei einigen Erkrankungen wie dem Morbus Hodgkin (siehe Maligne Lymphome) und dem Analkarzinom ist die erhöhte Inzidenz so offensichtlich, dass gefordert wird, sie als AIDS-definierende Erkrankungen einzustufen. So wird das relative Risiko für Analkarzinome auf 30-40 gegenüber der Normalbevölkerung geschätzt (Goedert 2000, Frisch 2001, Clifford 2005).
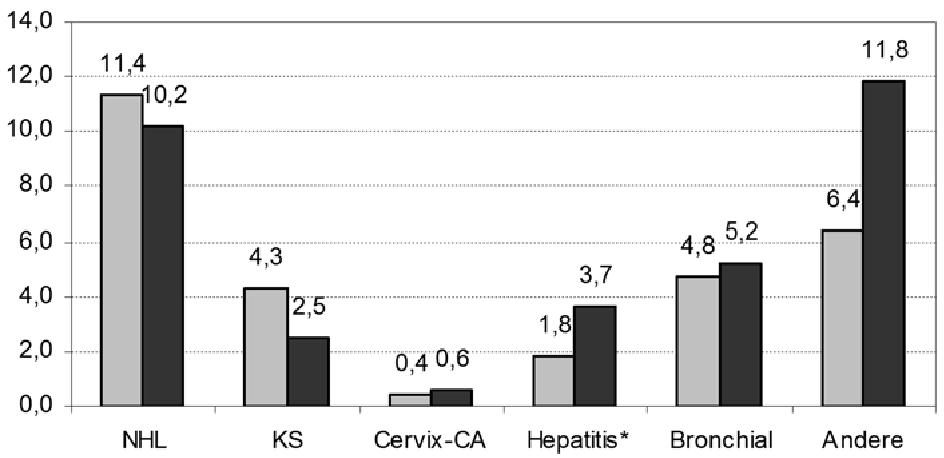
Non-ADM machen heute etwa ein Drittel aller malignen Neuerkrankungen bei HIV-Patienten aus. Sie sind damit etwa so häufig wie maligne Lymphome und das Kaposi-Sarkom (Engels 2006). Die Tendenz ist offenbar leicht steigend (Simard 2011). Non-ADM sind folglich auch ein signifikanter Mortalitätsfaktor bei HIV-Patienten. Sie führen in den Industrieländern inzwischen zu mehr Todesfällen als die ADM, Hepatitis C oder kardiovaskuläre Erkrankungen (Lewden 2007, DAD 2010). Die Abbildung zeigt den prozentualen Anteil maligner Erkrankungen an den Todesursachen insgesamt bei HIV-Patienten in Frankreich 2000 und 2005 (Bonnet 2009).
Abbildung 1: Anteil an malignen Erkrankungen an Todesursachen bei HIV-Patienten in Frankreich im Jahr 2000 (grau, n=924) und im Jahr 2005 (schwarz, n=1013). Zahlen nach Bonnet 2009. *Hepatitis-assoziierte Tumore.
Es wird deutlich, dass der Anteil der AIDS-definierenden Tumore NHL und KS eher abnimmt, der Anteil der Non-ADM eher zunimmt. Die Ursachen für die erhöhte Inzidenz vieler Malignome sind heterogen. In der D:A:D Studie waren die wesentlichen Risikofaktoren für tödliche Non-ADM steigendes Lebensalter und aktueller Nikotinkonsum, interessanterweise aber auch die Höhe der CD4-Zellen: Je niedriger, umso höher das Risiko für ein Non-ADM. Patienten mit < 50 CD4-Zellen/µl hatten ein 15fach erhöhtes Risiko gegenüber Patienten mit > 500 CD4-Zellen/µl (Monforte 2008). Diese Korrelation zwischen Non-ADM und Immunschwäche wurde auch in Auswertungen der Euro-SIDA-Studie (Reekie 2010) und einer großen französischen Studie (Guiget 2009) bestätigt. In einer US-Datenbankanalyse von über 300.000 AIDS-Patienten (Frisch 2001) waren einige Malignome mit einer Immunschwäche assoziiert: das Hodgkin-Lymphom, Lungentumore, Peniskarzinom, Weichteil-Malignome, Hoden- und Lippenkarzinome.
Allerdings erklärt die Immunschwäche sicher nicht alles. Auch Lebensstil (Nikotinkonsum, Alkohol, UV-Exposition), Koinfektionen (HPV, HBV, HCV) und andere Faktoren spielen eine Rolle. Schon angesichts des steigenden Lebensalters der HIV-Patienten ist damit zu rechnen, dass die Inzidenz vieler Malignome zunehmen wird (Shiels 2011). ART hat übrigens wahrscheinlich nur einen geringen Einfluss auf die Inzidenz der Non-ADM. Therapiepausen erhöhen das Risiko für Non-ADM nicht, im Gegensatz zu den ADM (Silverberg 2007).
Früherkennung und Vorsorge
Ob HIV-Patienten mehr und häufiger Vorsorge bzw. Früherkennungsuntersuchungen brauchen als HIV-negative Personen, ist unklar. Zumindest hinsichtlich des Analkarzinoms scheint es Hinweise für einen Benefit zu geben (siehe unten). Beim Kolonkarzinom ist die Lage nicht eindeutig, obwohl belegt ist, dass bei HIV-Patienten anlässlich Screening-Koloskopien häufiger neoplastische Veränderungen gefunden werden (Bini 2009). Die Motivation hinsichtlich dieser Untersuchung hält sich offenbart bei HIV-Patienten und ihren Behandlern jedoch (noch) in Grenzen. Im Vergleich zur Normalbevölkerung werden HIV-Patienten sogar weniger koloskopiert als HIV-negative Patienten (Reinhold 2005). Für das PSA-Screening gibt es bei HIV-Patienten über die immerwährende Diskussion zum Nutzen in der Allgemeinbevölkerung hinaus bislang keine spezifischen Empfehlungen. Zu den gynäkologischen Untersuchungen siehe auch das Kapitel Gynäkologie. Bei HCV-koinfizierten Patienten könnten regelmäßige (halbjährliche) Sonographien von Vorteil sein, wie kürzlich eine Studie an 70 Patienten zeigte: Hepatozelluläre Karzinome bei regelmässig gescreenten Patienten waren bei ihrer Entdeckung weniger fortgeschritten, was sogar ein etwas besseres Überleben zur Folge hatte (Nunez 2010).
Schließlich ist die Unterstützung bei der Rauchentwöhnung heute zu einem wesentlichen Bestandteil der medizinischen Versorgung geworden – Rauchen trägt auch bei HIV-Patienten wesentlich zur Mortalität bei (Lifson 2010). Während von Patienten oft überflüssige „Vorsorge“-Untersuchungen gefragt und sogar eingefordert werden („sollen wir nicht mal wieder röntgen?“), wird meist vergessen: Eine Nikotinkarenz ist und bleibt die wichtigste Vorsorge, auch für maligne Erkrankungen! Auch die Vermeidung übermäßiger Adipositas und ein gesunder Lebensstil bewirken vermutlich weitaus mehr als kostspielige Untersuchungen.
Behandlung
Ein Problem der Therapie vieler Non-ADM ist, dass nicht nur oft wenig zu Chemotherapeutika und ART-Interaktionen bekannt, sondern auch die neuen zielgerichteten Substanzen bei HIV-Patienten größtenteils noch unerforscht sind. Prospektive Studien gibt es so gut wie keine, zu Imatinib, Erlotinib, Sunitinib, Bortezomib, Sorafenib oder Temsirolimus bei HIV liegen kaum Daten vor (Review: Deeken 2009). Für viele maligne Erkrankungen gibt es lediglich kleine Fallserien. Meist sind die HIV-Patienten jünger sind als Erkrankte aus der Normalbevölkerung, was allerdings auch an einer besseren Überwachung liegen könnte (Shiels 2010). Die in den letzten Jahren veröffentlichen Erfahrungen bei so unterschiedlichen Entitäten wie dem Glioblastom (Hall 2009) oder Karzinomen des Kolons (Chapman 2009), der Blase (Gaughan 2009), der Prostata (Pantanowitz 2008) oder des Ösophagus (Stebbing 2010) zeigen allerdings auch, dass HIV-Patienten grundsätzlich von den jüngsten und bisweilen bemerkenswerten Fortschritten der Onkologie profitieren können. Sie sollten meist so behandelt werden, wie HIV-negative Patienten auch – allerdings sind dabei oft vermittelnde Gespräche mit Onkologen notwendig, deren HIV-Weltbild mitunter heute noch von Nihilismus geprägt ist.
Analkarzinom
Infektionen mit humanen Papillomviren (HPV) sind eine der am häufigsten sexuell übertragenen Virusinfektionen überhaupt. HPV gehören zur Familie der Papovaviridae und infizieren die Basalzellen der Epithelien von Haut und Schleimhaut. HIV-Patienten haben ein 2-6-fach erhöhtes Risiko für anale HPV-Infektionen, und zwar unabhängig von Geschlecht, sexuellen Praktiken und Vorlieben (Palefsky 1998, Piketty 2003). Das Risiko für persistierende HPV-Infektionen liegt 7-fach höher und ist invers mit der CD4-Zellzahl korreliert (Piketty 2003). Mittlerweile sind fast 100 verschiedene HPV-Typen bekannt, etwa 20 davon sind mit Anal- oder Zervixkarzinomen assoziiert. HPV-16 und -18 haben ein besonders hohes onkogenes Potential, bei ihnen besteht ein erhöhtes Risiko für Analkarzinome.
Bei HIV-Patienten bestehen oft Koinfektionen mit mehreren HPV-Subtypen. In einer Untersuchung aus Bochum (Kreuter 2005) wurden bei 103 männlichen Patienten in 86 % eine anale HPV-Infektion gefunden, darunter vor allem mit HPV-16 (53 %) und HPV-18 (27 %), aber auch mit HPV-58 (22 %) und HPV-83 (22 %).
Die persistierende HPV-Infektion führt zunächst zu präkanzerösen Vorstufen, den analen intraepithelialen Neoplasien (AIN). AIN werden histologisch nach dem Grad der Dysplasie in Grad 1 (milde), Grad 2 (moderat) und Grad 3 (schwer) eingeteilt. Bei schweren AIN ist die gesamte Epidermis betroffen, das Risiko für ein Analkarzinom ist hoch (Berry 2009). Obwohl eine Beziehung zum Ausmaß der Immunschwäche besteht (Melbye 1995), ist der Einfluss von ART nicht eindeutig. In einigen Studien blieb die AIN-Prävalenz auch mit ART hoch (Fox 2003, Gonzalez-Ruiz 2004, Palefsky 2005), in einer anderen war dagegen ein protektiver Effekt zu beobachten (Wilkin 2004). In einer eigenen Kohorte von 121 Patienten war die große Mehrheit der Patienten langjährig antiretroviral erfolgreich behandelt, die CD4-Zellen lagen im Median bei fast 400/μl (Hoffmann 2011).
Die Inzidenz von Analkarzinomen scheint zuzunehmen: In einer Studie aus San Francisco (Diamond 2005) stieg die Rate 1996-2000 gegenüber 1991-1995 um das Dreifache. Gegenüber der Normalbevölkerung war das Risiko für invasive Analkarzinome bei männlichen Patienten nach 1996 um das 300-fache erhöht. Ähnliche Daten wurden aus Frankreich berichtet (Piketty 2008). Allerdings: Was in San Francisco oder Frankreich gilt, ist nicht unbedingt auf andere Regionen übertragbar. In einer britischen Kohorte fand sich keine signifikante Zunahme der Inzidenz, obgleich auch hier das relative Risiko für Analkarzinome gegenüber der Normalbevölkerung in den letzten Jahren fast bei 200 lag (Bower 2005). Auch in einer neueren Studie aus den USA, interessanterweise aus Kalifornien, stieg das insgesamt 80-fach erhöhte Risiko nicht, sondern sank sogar von 172 zwischen 1996-1999 auf 45 in 2004-2007 (Silverberg 2009). Die oft gebetsmühlenartig wiederholte These, wonach in den letzten Jahren weltweit ein dramatischer Zuwachs zu beobachten wäre, lässt sich so jedenfalls nicht eindeutig belegen.
Das häufigste Symptom bei Analkarzinomen sind rektale Blutungen. Ein Patient, der über Blut im Stuhl berichtet, muss zum Proktologen! Mit der vom Patienten oft geäußerten Verdachtsdiagnose Hämorrhoiden sollte man sich nicht zufrieden geben. Andere Symptome sind Brennen, Schmerzen beim Stuhlgang oder Pruritus. Ist bereits ein Analkarzinom entstanden, liegen histologisch meistens Plattenepithelkarzinome, seltener auch Übergangsepithelkarzinome vor. Bereits früh können Analkanal und Sphinkter infiltriert sein. Regionale Lymphknoten sind je nach Lokalisation des Analkarzinoms betroffen. Tiefsitzende Analkarzinome infiltrieren inguinal, mittlere pelvin, hochsitzende mesenterial. Fernmetastasen sind selten. Neben Proktoskopie und möglichst Endosonografie sollte dennoch immer ein CT-Abdomen und des Beckens gemacht werden.
Bei manifestem Analkarzinom wird bei kleinen Befunden von < 2 cm nach Möglichkeit kontinenzerhaltend operiert, eine adjuvante Chemo- oder Strahlentherapie ist nicht notwendig. Größere Läsionen werden dagegen mit einer kombinierter Radiochemotherapie (Mitomycin 10 mg/m2 an Tag 1 und 29 und 5-FU 1000 mg/m2 an Tag 1-5 und Tag 29-33, mit anschließender Radiatio bis 50 Gy fraktioniert) behandelt. Auch intensivere Therapien sind möglich (Blazy 2005). Zu beachten sind die Komplikationen, die unter einem solchen Regime auftreten können. Was schief gehen kann, geht schief: Wir haben einen Patienten erlebt, der erst ein schweres Paravasat unter Mitomycin, dann einen Myokardinfarkt unter 5-FU und schließlich eine perforierende, kotige Strahlenkolitis entwickelte.
Immer sollten die Patienten in onkologischen Abteilungen mitbetreut werden. Nach Abschluss der Radiochemotherapie wird halbjährlich proktoskopiert. Obgleich ein positiver Effekt bislang nicht gesichert ist (Bower 2005), sollten HIV-Patienten mit Analkarzinom eine ART bekommen. Die Prognose scheint insgesamt nicht schlechter zu sein als bei HIV-negativen Patienten (Chiao 2008).
Behandlung der Vorstufen, Früherkennung
Da in der Regel zwischen AIN und der Manifestation des Analkarzinoms mehrere Jahre vergehen, ist eine frühe Behandlung wichtig. Bei AIN 1 ist eine topische Therapie mit Imiquimod (oder Podophylotoxin) gerechtfertigt, AIN 2+3 sollten operativ (elektrokaustische Abtragung mittels Schlinge) oder mittels Laserablation entfernt werden. Auch Infrarotkoagulation ist möglich (Stier 2008). Kondylome sollten ebenfalls vom Proktologen beseitigt werden (u. a. Elektrokoagulation, Kryotherapie). Auch hier ist eine alleinige topische Therapie mit dem Immunmodulator Imiquimod (Aldara®-Creme) möglich, die Effekte sind bei HIV-infizierten Patienten allerdings häufig weniger eindrucksvoll als bei nicht infizierten Personen. Als Nachbehandlung wird durch Imiquimod das Rezidivrisiko allerdings wohl doch deutlich gesenkt. Imiquimod wirkt nicht direkt antiviral, sondern wahrscheinlich über eine Zytokininduktion zytolytisch-destruierend. Wichtigste Nebenwirkung ist ein lokales Erythem (Erythem heisst Wirkung!), seltener sind Brennen und Pruritus. Zu schweren Hautreaktionen kommt es nur selten. Für die Früherkennung des Analkarzinoms wird in Deutschland derzeit ein Vorsorgeprogramm aufgebaut (Kreuter 2005). Von einigen Experten wird inzwischen sogar gefordert, jährlich peri- und intraanale Abstriche zu machen. Allerdings scheint es derzeit noch zu früh, um eine Vorsorge uneingeschränkt für alle HIV-infizierten Patienten empfehlen zu können (Palefsky 2009). Ob sich die Erfolge einer HPV-Vakzine, die sich beim Zervixkarzinom als protektiv für intraepitheliale Neoplasien und persistierende HPV-Infektionen erwiesen hat (Harper 2006), ohne weiteres auf Analkarzinome übertragen lassen, ist ebenfalls noch unklar. Erste Berichte sind allerdings ermutigend (Anderson 2009, Wilkin 2010).
Hodentumore
Hodentumore sind die häufigste Krebsart bei Männern zwischen 20 und 35. Bei HIV-Patienten ist das relative Risiko ist im Vergleich zur alters-gematchten Allgemeinbevölkerung noch um den Faktor 2-5 erhöht (Frisch 2001, Powles 2003). Dies gilt wohl vor allem für Seminome, weniger für Nicht-Seminome (Goedert 2007). Die bislang größten Fallsammlungen berichten über 34 bzw. 35 Patienten, darunter 26 bzw. 16 Seminome und 18 bzw. 9 nichtseminomatöse Keimzelltumoren (Powles 2003, Fizazi 2001). Die medianen CD4-Zellen lagen bei Diagnose zwischen 300 und 350/µl, mit allerdings großer Spannbreite. Die Prognose war insgesamt gut und in einer Matched-Pair-Studie nicht schlechter als bei HIV-Negativen (Powles 2004). Auch andere Studien berichten von recht günstigen Verläufen (Fizazi 2001). HIV-Patienten sollten mit den Standardregimen behandelt werden, die auch für HIV-negative Patienten empfohlen werden. Diese bestehen je nach Histologie und Stadium aus Orchiektomie, Lymphknotenexstirpation bzw. Radiatio und/oder einer Platin-basierten Chemotherapie. Auch Hochdosistherapien sind möglich (Hentrich 2009). Die Behandlung sollte ein onkologisch bewanderter Urologe in Zusammenarbeit mit einem HIV-Spezialisten vornehmen.
Bronchialkarzinome
In der Normalbevölkerung ist das Bronchialkarzinom (BC) bei Männern die häufigste zum Tode führende Krebsart, bei Frauen liegt es, Tendenz steigend, bereits an dritter Stelle. Bei HIV-Patienten scheint das Risiko zuzunehmen. In Frankreich führt das BC inzwischen mit rund 5 % aller Todesursachen deutlich häufiger zum Tode als Kaposi-Sarkome (Bonnet 2009). In einer englischen Kohorte, in der das relative Risiko in der „prä-HAART-Ära“ noch ungefähr auf dem Niveau der Normalbevölkerung lag, stieg das relative Risiko in den letzten Jahren auf den Faktor 8 an (Bower 2003). In anderen Kohorten liegt das relative Risiko recht konstant zwischen 3-10 (Engels 2006, Cadranel 2006, Dal Maso 2009). Das Risiko insgesamt nimmt mit zunehmender Immunschwäche deutlich zu (Guiguet 2009, Reekie 2011). In einer eigenen retrospektiven Kohorte (n=72) waren allerdings die meisten Patienten antiretroviral erfolgreich behandelt, die Viruslast unter der Nachweisgrenze, die CD4-Zellen im Median bei fast 400/μl (Hoffmann 2011).
Die Gründe für den Anstieg dürften zum Teil relativ banal sein: Erstens leben HIV-Patienten länger und haben somit mehr Zeit, ein BC zu entwickeln, und zweitens rauchen HIV-Patienten zuviel, in einigen Ambulanzen sind es 60-70 %. Man sollte sich also durchaus auch über das Rauchen unterhalten: Time to quit – Möglichkeiten zur Entwöhnung gibt es genug (Niaura 2000). Allerdings scheint es auch noch andere Faktoren zu geben, die neben Alter und Nikotin zum erhöhten Risiko beitragen (Kirk 2007, Chaturvedi 2007). Dafür spricht auch, dass mit den Adenokarzinomen vor allem jener Subtyp erhöht ist, der von allen BC-Subtypen am wenigsten mit erhöhtem Nikotinkonsum assoziiert ist (Tirelli 2000, Cadranel 2006). Da oft kein schwerer Immundefekt vorliegt, werden auch andere Faktoren postuliert, darunter spezifische Infektionen in der Lunge und eine dadurch bedingte Narbenbildung, aber auch erhöhte Level proinflammatorischer Zytokine in der Lunge oder erniedrigte Glutathion-Level, wie sie bei HIV-Infektion zu finden sind. Diese Faktoren könnten die durch Rauchen entstandenen Schäden begünstigen bzw. verschlimmern. HIV-Patienten scheinen insgesamt gegenüber Karzinogenen empfindlicher zu sein (Engels 2006, Kirk 2007, Chaturvedi 2007). In der US-Veteranen-Kohorte blieb für HIV-Patienten ein erhöhtes Risiko bestehen, auch nachdem für Rauchen, Alter, ethnische Herkunft und COPD adjustiert wurde (Sigel 2010).
Diagnostisch-therapeutisch gilt wie bei HIV-negativen Patienten, dass nur jene eine Chance haben, deren BC früh erkannt wird. Die Symptome sind unspezifisch, und wenn sie auffallen, ist es meist zu spät. Bei HIV-Patienten wird die Diagnose selten rechtzeitig gestellt. In unserer eigenen Kohorte von 72 Fällen aus den Jahren 2000-2010 waren nur 34 % in den potentiell noch operablen Stadien I-IIIa (Hoffmann 2011). Patienten in frühen Tumor-Stadien sollten möglichst in kurativer Intention operiert werden, Chemotherapien gewähren dagegen nur einen kurzen Aufschub um einige Monate. Die mediane Überlebenszeit lagen in früheren Kohorten bei 4-8 Monaten (Tirelli 2000, Spano 2004, Powles 2003, Cadranel 2006, Lavolé 2006+2009), in unserer eigenen Auswertung 12 Monate – die Höhe der CD4-Zellen und limitierte Stadien waren dabei wesentliche Einflussfaktoren (Hoffmann 2011). Vor allem in frühen Stadien ist auch ein Langzeit-Überleben möglich.
Sofern eine Chemotherapie indiziert ist, sollte bei einem HIV-Patienten mit nicht kleinzelligem Bronchialkarzinom (NSCLC) in sonst gutem Zustand eine Standard- Therapie aus Cis- oder Carboplatin plus entweder einem Taxan (Paclitaxel), Gemci- tabine oder Navelbine begonnen werden. Diese Kombinationen erzielen bei HIV- negativen Patienten ähnliche Ansprechraten. Bei HIV-Patienten gibt es kaum Therapie-Studien. Carboplatin/Gemcitabine scheinen ganz gut vertragen zu werden (Bridges 2008). In zweiter Linie kommen auch Pemetrexed oder Erlotinib, ein Inhibitor der EGFR-Tyrosinkinase in Betracht. HIV-Behandler sollten versuchen, den angesichts der begleitenden HIV-Infektion mitunter nihilistisch gestimmten Onkologen davon zu überzeugen, dass HIV in diesem Fall das geringste Problem ist. HIV ist für kein Medikament eine Kontraindikation. In Zeiten, in denen auch autologe Stammzelltransplantationen (bei AIDS-NHL) kein prinzipielles Problem mehr darstellen, sollte sich die Behandlung an den Empfehlungen für HIV-negative Patienten orientieren. Bei schlechtem Allgemeinzustand kann eine gut verträgliche Kombination aus Gemcitabine und Navelbine versucht werden, die zumindest bei einigen Patienten für kurze Zeit die Progression aufhält.
Literatur
Anderson JS, Hoy J, Hillman R, et al. A randomized, placebo-controlled, dose-escalation study to determine the safety, tolerability, and immunogenicity of an HPV-16 therapeutic vaccine in HIV-positive participants with oncogenic HPV infection of the anus. J AIDS 2009, 52:371-81.
Berry M, Jay N, Cranston R, et al. Progression of high-grade anal intraepithelial neoplasia to invasive anal cancer among HIV+ men who have sex with men. Abstract 867, 16th CROI 2009, Montréal.
Bini EJ, Green B, Poles MA. Screening colonoscopy for the detection of neoplastic lesions in asymptomatic HIV-infected subjects. Gut 2009, 58:1129-34.
Blazy A, Hennequin C, Gornet JM, Furco A, Gerard L, Lemann M, Maylin C. Anal carcinomas in HIV-positive patients: high-dose chemoradiotherapy is feasible in the era of HAART. Dis Colon Rectum 2005, 48:1176-81.
Bonnet F, Burty C, Lewden C, et al. Changes in cancer mortality among HIV-infected patients: the Mortalité 2005 Survey. Clin Infect Dis 2009, 48:633-9.
Bower M, Powles T, Nelson M, et al. HIV-related lung cancer in the era of highly active antiretroviral therapy. AIDS 2003, 17:371-5.
Bower M, Powles T, Newsom-Davis T, et al. HIV-associated anal cancer: has HAART reduced the incidence or improved the outcome? J AIDS 2004, 37:1563-5.
Bridges BB, Thomas L, Hausner PF, et al. Phase II trial of gemcitabine/carboplatin followed by paclitaxel in patients with performance status=2,3 or other significant co-morbidity (HIV infection or s/p organ transplantation) in advanced non-small cell lung cancer. Lung Cancer 2008; 61:61-6
Cadranel J, Garfield D, Lavole A, Wislez M, Milleron B, Mayaud C. Lung cancer in HIV infected patients: facts, questions and challenges. Thorax 2006;61:1000-8.
Chapman C, Aboulafia DM, Dezube BJ, Pantanowitz L. Human immunodeficiency virus-associated adenocarcinoma of the colon: clinicopathologic findings and outcome. Clin Colorectal Cancer 2009, 8:215-9.
Chaturvedi AK, Pfeiffer RM, Chang L, Goedert JJ, Biggar RJ, Engels EA. Elevated risk of lung cancer among people with AIDS. AIDS 2007;21:207-13.
Chiao EY, Giordano TP, Richardson P, El-Serag HB. HIV-associated squamous cell cancer of the anus: epidemiology and outcomes in the highly active antiretroviral therapy era. J Clin Oncol 2008; 26:474-9.
Clifford GM, Polesel J, Rickenbach M, et al. Cancer risk in the Swiss HIV Cohort Study: associations with immunodeficiency, smoking, and highly active antiretroviral therapy. J Natl Cancer Inst 2005, 97:425-32.
D:A:D Study Group. Factors associated with specific causes of death amongst HIV-positive individuals in the D:A:D Study. AIDS 2010, 24:1537-48.
Dal Maso L, Polesel J, Serraino D, et al. Pattern of cancer risk in persons with AIDS in Italy in the HAART era. Br J Cancer 2009, 100:840-7.
Deeken JF, Pantanowitz L, Dezube BJ. Targeted therapies to treat non-AIDS-defining cancers in patients with HIV on HAART therapy: treatment considerations and research outlook. Curr Opin Oncol 2009, 21:445-54.
Diamond C, Taylor TH, Aboumrad T, Bringman D, Anton-Culver H. Increased incidence of squamous cell anal cancer among men with AIDS in the era of highly active antiretroviral therapy. Sex Transm Dis 2005, 32:314-20.
Engels EA, Brock MV, Chen J, et al. Elevated incidence of lung cancer among HIV-infected individuals. J Clin Oncol 2006, 24:1383-8.
Engels EA, Pfeiffer RM, Goedert JJ, et al. Trends in cancer risk among people with AIDS in the United States 1980-2002. AIDS 2006;20:1645-54.
Fizazi K, Amato RJ, Beuzeboc P, et al. Germ cell tumors in patients infected by the human immunodeficiency virus. Cancer 2001, 92:1460-7.
Fox P, Stebbing J, Portsmouth S, et al. Lack of response of anal intra-epithelial neoplasia to highly active antiretroviral therapy. AIDS 2003, 17:279-80.
Franceschi S, Lise M, Clifford GM, et al. Changing patterns of cancer incidence in the early- and late-HAART periods: the Swiss HIV Cohort Study. Br J Cancer 2010, 103:416-22.
Frisch M, Biggar RJ, Engels EA, Goedert JJ. Association of cancer with AIDS-related immunosuppression in adults. JAMA 2001, 285:1736-45.
Gaughan EM, Dezube BJ, Bower M, et al. HIV-associated bladder cancer: a case series evaluating difficulties in diagnosis and management. BMC Urol 2009, 9:10.
Goedert JJ, Purdue MP, McNeel TS, McGlynn KA, Engels EA. Risk of germ cell tumors among men with HIV/acquired immunodeficiency syndrome. Cancer Epidemiol Biomarkers Prev 2007;16:1266-9.
Goedert JJ. The epidemiology of acquired immunodeficiency syndrome malignancies. Semin Oncol. 2000, 27:390-401.
Gonzalez-Ruiz C, Heartfield W, Briggs B, et al. Anorectal pathology in HIV/AIDS-infected patients has not been impacted by highly active antiretroviral therapy. Dis Colon Rectum 2004, 47:1483-6.
Guiguet M, Boué F, Cadranel J, et al. Effect of immunodeficiency, HIV viral load, and antiretroviral therapy on the risk of individual malignancies (FHDH-ANRS CO4): a prospective cohort study. Lancet Oncol 2009, 10:1152-9.
Hakimian R, Fang H, Thomas L, Edelman MJ. Lung cancer in HIV-infected patients in the era of HAART. J Thorac Oncol 2007;2:268-72.
Hall JR, Short SC. Management of glioblastoma multiforme in HIV patients: a case series and review of published studies. Clin Oncol 2009, 21:591-7.
Harper DM, Franco EL, Wheeler C, et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet 2006, 367:1247-55.
Hentrich M, Schiel X, Niedermeier A, et al. Successful salvage high-dose chemotherapy and autologous stem-cell transplantation in HIV-related germ-cell tumor. Ann Oncol 2009, 20:1900-1.
Hoffmann C, Sabranski M, Wyen C, et al. Clinical characteristics and outcome of HIV+ patients with invasive anal cancer. Abstract 870, 18th CROI 2011, Boston.
Hoffmann C, Sabranski M, Wyen C, et al. Mortality remains high in HIV-associated lung cancer. Abstract 868, 18th CROI 2011, Boston.
Kirk GD, Merlo C, O´ Driscoll P, et al. HIV infection is associated with an increased risk for lung cancer, independent of smoking. Clin Infect Dis 2007;45:103-10.
Kreuter A, Brockmeyer NH, Hochdorfer B, et al. Clinical spectrum and virologic characteristics of anal intraepithelial neoplasia in HIV infection. J Am Acad Dermatol 2005, 52:603-8.
Lavolé A, Chouaïd C, Baudrin L, et al. Effect of highly active antiretroviral therapy on survival of HIV infected patients with non-small-cell lung cancer. Lung Cancer. 2009 Jan 8. [Epub ahead of print]
Lavole A, Wislez M, Antoine M, et al. Lung cancer, a new challenge in the HIV-infected population. Lung Cancer 2006, 51:1-11.
Lewden C, May T, Rosenthal T, et al. Causes of death among HIV-infected adults in France in 2005 and evolution since 2000. Abstract 976, 14th CROI 2007, Los Angeles.
Lifson AR, Neuhaus J, Arribas JR, et al. Smoking-related health risks among persons with HIV in the Strategies for Management of Antiretroviral Therapy clinical trial. Am J Public Health 2010, 100:1896-903.
Melbye M, Cote TR, Kessler L, et al. High incidence of anal cancer among AIDS patients. Lancet 1994, 343:636-9.
Monforte A, Abrams D, Pradier C, et al. HIV-induced immunodeficiency and mortality from AIDS-defining and non-AIDS-defining malignancies. AIDS 2008;22;2143-53.
Niaura R, Shadel WG, Morrow K, et al. HIV infection, AIDS, and smoking cessation: the time is now. Clin Infect Dis 2000, 31: 808-12.
Nunez M, Kikuchi L, Barreiro P, et al. Screening for hepatocellular carcinoma (HCC) in HIV/HCV-co-infected patients: impact on staging, therapy, and survival. Abstract 685, 17th CROI 2010, San Francisco.
Palefsky JM, Holly EA, Efirdc JT, et al. Anal intraepithelial neoplasia in the highly active antiretroviral therapy era among HIV-positive men who have sex with men. AIDS 2005;19:1407-14.
Palefsky JM, Holly EA, Ralston ML, et al. Anal squamous intraepithelial lesions in HIV-positive and HIV-negative homosexual and bisexual men: prevalence and risk factors. JAIDS 1998, 17:320-326.
Palefsky JM. Anal cancer prevention in HIV-positive men and women. Curr Opin Oncol 2009, 21:433-8.
Pantanowitz L, Bohac G, Cooley TP, Aboulafia D, Dezube BJ. Human immunodeficiency virus-associated prostate cancer: clinicopathological findings and outcome in a multi-institutional study. BJU Int 2008, 101:1519-23.
Piketty C, Darragh TM, Da Costa M, et al. High prevalence of anal human papillomavirus infection and anal cancer precursors among HIV-infected persons in the absence of anal intercourse. Ann Intern Med 2003, 138:453-9.
Piketty C, Selinger-Leneman H, Grabar S, et al. Marked increase in the incidence of invasive anal cancer among HIV-infected patients despite treatment with combination antiretroviral therapy. AIDS 2008, 22:1203-11.
Powles T, Bower M, Daugaard G, et al. Multicenter study of HIV-related germ cell tumors. J Clin Oncol 2003, 21:1922-7.
Powles T, Bower M, Shamash J, et al. Outcome of patients with HIV-related germ cell tumours: a case-control study. Br J Cancer 2004, 90:1526-30.
Powles T, Thirwell C, Newsom-Davis T, et al. Does HIV adversely influence the outcome in advanced non-small-cell lung cancer in the era of HAART? Br J Cancer 2003, 89:457-9.
Reekie J, Kosa C, Engsig F, et al. Relationship between current level of immunodeficiency and non-acquired immunodeficiency syndrome-defining malignancies. Cancer 2010, 116:5306-15.
Reekie J, Mocroft A, Engsig F. Relationship between current level of immunodeficiency and non-AIDS-defining malignancies. Abstract 860, 16th CROI 2009, Montréal.
Reinhold JP, Moon M, Tenner CT, Poles MA, Bini EJ. Colorectal cancer screening in HIV-infected patients 50 years of age and older: missed opportunities for prevention. Am J Gastroenterol 2005, 100:1805-12.
Shiels MS, Pfeiffer RM, Engels EA. Age at cancer diagnosis among persons with AIDS in the United States. Ann Intern Med 2010, 153:452-60.
Shiels MS, Pfeiffer RM, Gail MH, et al. Cancer Burden in the HIV-Infected Population in the United States. J Natl Cancer Inst. 2011 Apr 11. [Epub ahead of print]
Sigel K, Wisnivesky J, Justice A, et al. HIV infection is an independent risk factor for lung cancer. Abstract 30, 17th CROI 2010, San Francisco.
Silverberg M, Leyden W, Chao C. Infection-related non-AIDS-defining cancer risk in HIV-infected and -uninfected persons. Abstract 30, 16th CROI 2009, Montréal.
Silverberg MJ, Neuhaus J, Bower M, et al. Risk of cancers during interrupted antiretroviral therapy in the SMART study. AIDS 2007; 21:1957-63.
Simard EP, Pfeiffer RM, Engels EA. Cumulative incidence of cancer among individuals with acquired immunodeficiency syndrome in the United States. Cancer 2011, 117:1089-96.
Spano JP, Massiani MA, Bentata M, et al. Lung cancer in patients with HIV Infection and review of the literature. Med Oncol 2004, 21:109-15.
Stebbing J, Krown SE, Bower M, et al. Primary esophageal carcinoma in the era of highly active antiretroviral therapy. Arch Intern Med 2010, 170:203-7.
Stier EA, Goldstone SE, Berry JM, et al. Infrared coagulator treatment of high-grade anal dysplasia in HIV-infected individuals: an AIDS malignancy consortium pilot study. J AIDS 2008;47:56-61.
Tirelli U, Spina M, Sandri S, et al. Lung carcinoma in 36 patients with human immunodeficiency virus infection. The Italian Cooperative Group on AIDS and Tumors. Cancer 2000. 88:563-569.
Wilkin T, Lee JY, Lensing SY, et al. Safety and immunogenicity of the quadrivalent human papillomavirus vaccine in HIV-1-infected men. J Infect Dis 2010, 202:1246-53.
Wilkin TJ, Palmer S, Brudney KF, Chiasson MA, Wright TC. Anal intraepithelial neoplasia in heterosexual and homosexual HIV-positive men with access to antiretroviral therapy. J Infect Dis 2004, 190:1685-91.