– von Hendrik Streeck und Marcus Altfeld –
Einleitung
Die akute HIV-1-Infektion verursacht in 40–90 % der Fälle vorübergehend Symptome, was mit einer hohen Replikationsrate von HIV-1 und einer expandierenden virus-spezifischen Immunantwort einhergeht. Mit weltweit täglich 7.000 Fällen und circa 80 Fällen in Europa ist die akute HIV-1-Infektion eine wichtige Differentialdiagnose bei Fieber unklarer Genese, makulopapulärem Hautausschlag und Lymphadenopathie (UNAIDS 2010).
Die akute Infektion wird jedoch in der Mehrzahl nicht diagnostiziert, da oft andere virale Erkrankungen („Grippe“ oder Mononukleose) für die Symptome verantwortlich gemacht werden. Zudem sind in diesem frühen Stadium keine HIV-1-spezifischen Antikörper nachweisbar; die Diagnose erfordert daher neben dem klinischen Verdacht, basierend auf Klinik und Anamnese (Expositionsrisiko), zusätzliche spezifische Tests wie den Nachweis von HIV-1-RNA oder p24-Antigen.
Eine schnelle Diagnose ist aus mehreren Gründen von großer Bedeutung. So werden wahrscheinlich etwa 50 % aller HIV-1-Neuinfektionen durch ebenfalls frisch infizierte Patienten verursacht (Brenner 2007). Tatsächlich lassen sich solche Cluster anhand phylogenetischer Sequenzanalysen nachweisen. Die akute HIV-Infektion scheint somit ein entscheidender Katalysator der weltweiten Pandemie zu sein. Eine schnelle Diagnose ist aber auch wichtig, da es Hinweise dafür gibt, dass eine kurzfristige antiretrovirale Therapie während dieser Phase einen langfristigen immunologischen Vorteil für den Patienten haben könnte (siehe unten).
Definition und Klassifikation
Die „akute“ HIV-1-Infektion (AHI) wird definiert durch entweder eine hohe HIV-1-Viruslast in der Abwesenheit eines positiven anti-HIV-1 ELISA – oder bei einem positiven HIV Test, wenn der Western Blot in weniger als drei Banden positiv ist. Von der „akuten“ ist die „frühe“ HIV-1 Infektion (EHI) zu unterscheiden, unter der man eine HIV-1-Infektion innerhalb der letzten sechs Monate versteht. Diese ist unabhängig von dem Serokonversionsstatus, allerdings muss ein negativer HIV-1 Test in den letzten 6 Monaten dokumentiert sein. AHI und EHI werden unter dem Begriff „primäre HIV-1 Infektion“ (PHI) zusammengefasst.
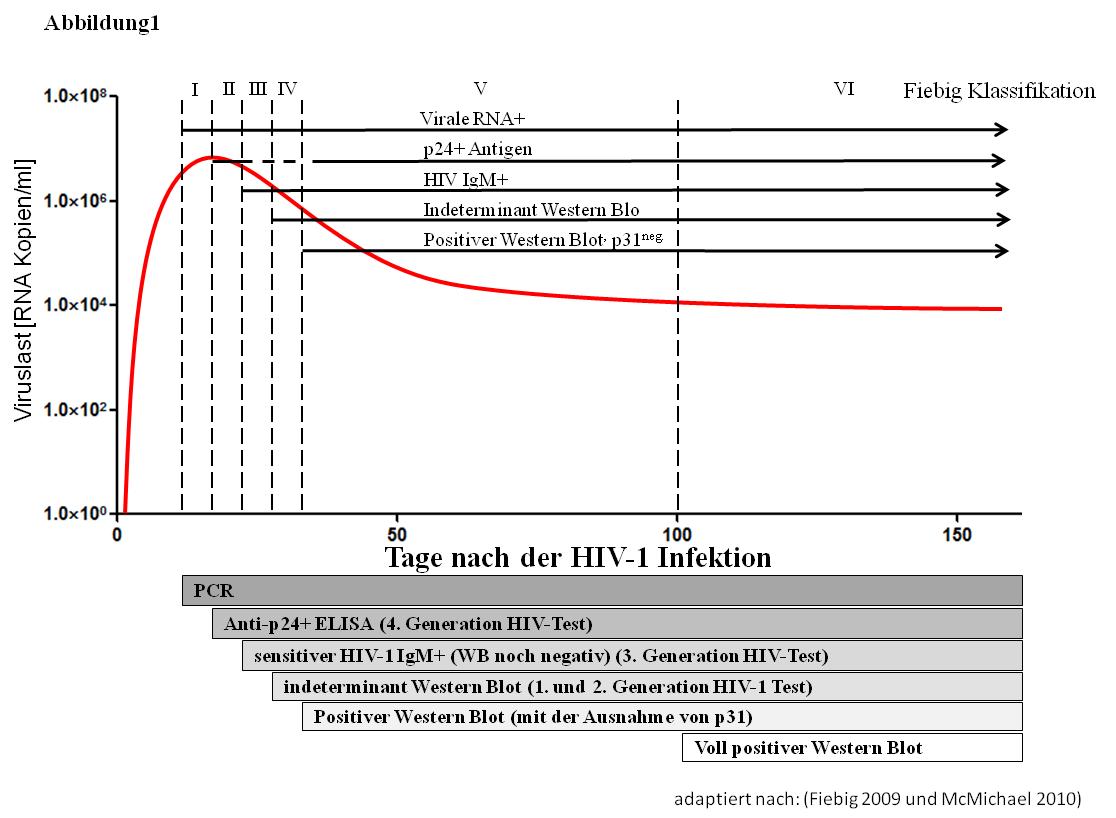
Ein 2009 vor allem aus wissenschaftlichen Zwecken eingeführtes Klassifizierungssystem (Fiebig 2009) unterteilt die akute HIV-1 Infektion noch genauer nach immunpathologischen Merkmalen(siehe Abbildung 1). Dabei handelt es sich vereinfacht beim Stadium I-III um die akute HIV-1 infektion, Stadium IV-VI entsprechen eher der frühen Infektion.
Klinik
Nach einer Inkubationszeit von einigen Tagen bis wenigen Wochen nach der HIV-Exposition manifestiert sich meist eine akute, grippeähnliche Erkrankung, die unterschiedlich stark ausgeprägt sein kann. Patienten mit schwerer und lang persistierender Symptomatik zeigen eine schnellere Progression zu AIDS (Pedersen 1989, Keet 1993, Vanhems 1998). Die klinischen Symptome der akuten HIV-1-Infektion wurden zuerst als Mononukleose-ähnliche Erkrankung beschrieben (Cooper 1985). Die häufigsten Symptome sind in Tabelle 1 zusammengefasst. Fast immer tritt Fieber zwischen 38°C und 40°C auf, das für circa 5-8 Tage besteht. Darüber hinaus tritt auch häufig ein makulopapulärer Hautausschlag auf, typischerweise 48-72 Stunden nach Fieber-Beginn. Dieser besteht dabei vor allem am Rumpf, der Halsregion und Gesicht. Weiterhin sind schmerzhafte orale Ulzerationen, Lymphadenopathie, Arthralgien, Pharyngitis, Abgeschlagenheit, Gewichtsverlust, aseptische Meningitis und Myalgien (Kahn 1998) beschrieben worden; in seltenen Fällen kann auch eine Myokarditis, Pankreatitis oder ein Nierenversagen auftreten.
Tabelle 1: Leitsymptome der akuten HIV-1-Infektion (aus: Hecht 2002) |
||
| Symptom |
Häufigkeit |
Odds Ratio (95% CI) |
| Fieber |
80 % |
5,2 (2,3-11,7) |
| Hautausschlag |
51 % |
4,8 (2,4-9,8) |
| Orale Ulzera |
37 % |
3,1 (1,5-6,6) |
| Arthralgie |
54 % |
2,6 (1,3-5,1) |
| Pharyngitis |
44 % |
2,6 (1,3-5,1) |
| Appetitverlust |
54 % |
2,5 (1,2-4,8) |
| Gewichtsverlust > 2,5 kg |
32 % |
2,8 (1,3-6,0) |
| Allgemeine Abgeschlagenheit |
68 % |
2,2 (1,1-4,5) |
| Myalgie |
49 % |
2,1 (1,1-4,2) |
| Fieber und Hautausschlag |
46 % |
8,3 (3,6-19,3) |
In einer Studie zeigten Fieber (80 %) und Abgeschlagenheit (68 %) die höchste Sensitivität für die klinische Diagnose, Gewichtsverlust (86 %) und orale Ulzerationen (85 %) dagegen die höchste Spezifität (Hecht 2002). Die Symptome Fieber und Hautausschlag (besonders in Kombination), gefolgt von oralen Ulzerationen und Pharyngitis, hatten den höchsten prädiktiven Wert für die Diagnose der akuten HIV-1-Infektion. In einer anderen Studie (Daar 2001) waren Fieber, Hautausschlag, Myalgien, Arthralgien und Nachtschweiß die besten Prädiktoren. Die symptomatische Phase der akuten HIV-1-Infektion dauert 7-10 Tage, selten länger als 14 Tage. Die unspezifische Natur der Symptome unterstreicht die Bedeutung einer detaillierten Risikoanamnese.
Diagnostik
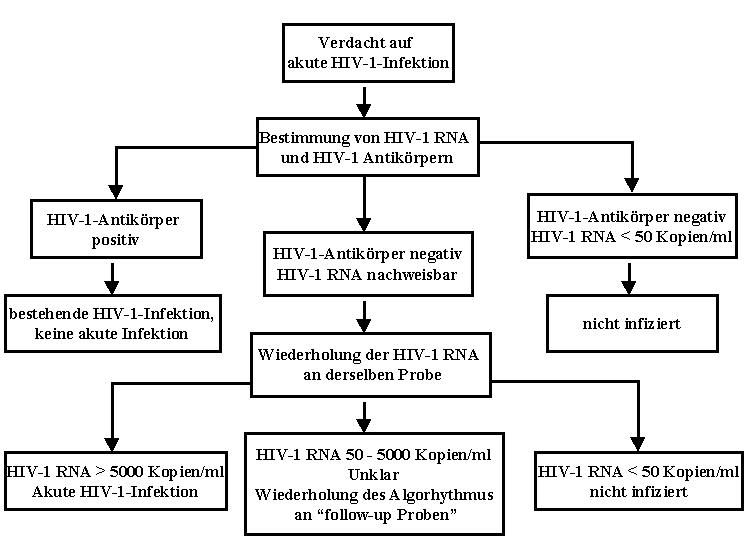
Obwohl eine akute HIV-1-Infektion aufgrund der Symptome und entsprechender Anamnese vermutet werden kann, ist die Labordiagnostik unerlässlich. Diese basiert auf dem Nachweis der HIV-1-Replikation, da diese früher als HIV-1-Antikörper zu finden ist. Verschiedene Tests stehen für die Diagnose zur Verfügung, die sensitivsten basieren auf dem Nachweis von HIV-1-RNA im Plasma.
In der oben bereits zitierten Studie von Hecht (2002) zeigten alle getesteten Nachweisverfahren für HIV-1-RNA (branched chain DNA, PCR und GenProbe) eine Sensitivität von 100 %, erbrachten aber in 2-5 % falsch positive Ergebnisse. Diese falsch positiven Testergebnisse liegen meistens unter 2.000 Kopien HIV-1-RNA/ml und somit weit unterhalb der hohen Werte, die normalerweise während der akuten HIV-1-Infektion auftreten (in eigenen Studien im Durchschnitt 13 x 106 Kopien HIV-1-RNA/ml, mit einer Spannbreite von 0,25–95,5 x 106 Kopien HIV-1-RNA/ml). Die wiederholte Bestimmung der HIV-1-RNA aus der gleichen Probe mit dem gleichen Test führte in allen falsch positiven Fällen zu einem negativen Testergebnis. Im Gegensatz dazu hat der Nachweis von p24-Antigen nur eine Sensitivität von 79 %, bei einer Spezifität von 99,5–99,96 %. Die Diagnose der akuten HIV-1-Infektion muss dann innerhalb der folgenden Wochen mit einem positiven HIV-1-Antikörper-Test (Serokonversion) bestätigt werden.
Derzeit sind vier verschiedene „HIV-Tests“ auf dem Markt, mit denen eine HIV-1-Infektion in der frühen Phase unterschiedlich gut diagnostiziert werden kann. Für eine korrekte Interpretation der Testergebnisse ist es dabei sehr wichtig, die unterschiedliche Sensitivität dieser Tests zu kennen: Die EIA-Tests der ersten und zweiten Generation weisen nur IgG-Antikörper nach und werden folglich erst positiv, wenn ein gewisser IgG-Antikörperspiegel erreicht ist. Drittgenerations-EIAs sind etwas sensitiver, weil sie auch IgM-Antikörper nachweisen können, die schon früher gebildet werden. Sie scheinen etwa drei Viertel der akuten Infektionen identifizieren zu können (Hecht 2002). Die Viertgenerations-EIA kombinieren einen p24 Antigen-EIA und einen Antikörper-EIA. Somit werden auch jene Patienten identifiziert, die zwar noch keine Antikörper, wohl aber bereits p24-Antigen gebildet haben. Dadurch wird die Zeitspanne zwischen Infektion und frühestmöglicher Diagnose zwar verkürzt (Ly 2007), allerdings öffnet sich ein zweites diagnostisches Fenster, wenn sich für eine kurze Zeit Antikörper und Antigen neutralisieren.
Während der akuten HIV-1-Infektion findet sich häufig ein deutlicher Abfall der CD4-Zellzahl, die später wieder ansteigt, meist aber nicht mehr den Ausgangswert erreicht. Im Gegensatz dazu steigt die CD8-Zellzahl zunächst an, was in einer CD4/CD8-Ratio von unter 1 resultieren kann. Klinisch ist die Infektiöse Mononukleose („Pfeiffersches Drüsenfieber“) die wichtigste Differentialdiagnose der akuten HIV-Infektion. Hepatitis, Influenza, Toxoplasmose, Lues und Medikamenten-Nebenwirkungen kommen ebenso in Frage.
Zusammenfassend besteht die wichtigste Aufgabe bei der Diagnose der akuten HIV-1-Infektion darin, diese überhaupt als Differentialdiagnose zu berücksichtigen. Der klinische Verdacht erfordert dann lediglich einen HIV-1-Antikörper-Test und möglicherweise die wiederholte Bestimmung der HIV-1-Viruslast, wie in Abbildung 1 dargestellt.
Immunologische und virologische Ereignisse
Während der akuten HIV-1-Infektion findet eine außerordentlich starke Virusvermehrung statt. Ohne die zu diesem Zeitpunkt noch nicht nachweisbare adaptive Immunantwort erreicht die Viruslast oft mehr als 100 Millionen Kopien HIV-1-RNA/ml. Es wird angenommen, dass während dieser Zeit wichtige pathogene Prozesse stattfinden. Dazu gehören die Aussaat der Viren in verschiedene Gewebe und die Zerstörung von CD4-T-Lymphozyten vor allem in Lymphgewebe und im lymphatischen Gewebe des Magen-Darm Trakts. Während der akuten HIV-1-Infektion fällt die CD4-Zellzahl deutlich ab. Gelegentlich werden sogar Werte beobachtet, die bereits zu diesem Zeitpunkt opportunistische Infektionen ermöglichen (Gupta 1993, Vento 1993). Obwohl die CD4-Zellzahl nach der Primärinfektion wieder ansteigt, erreicht sie ohne ART nur selten wieder die Ausgangswerte. Die sehr hohe HIV-1-Virämie ist meist nur von kurzer Dauer, was darauf hindeutet, dass sie durch eine Immunantwort oder einen Verlust der Zellen, die eine Virusreplikation erlauben, kontrolliert wird. In den folgenden Wochen fällt die Virämie um einige Logstufen ab, bis ein viraler Setpoint erreicht wird. Die Höhe dieses Setpoints ist ein starker Prädiktor für die spätere Krankheitsprogression (Mellors 1996+2007).
Im Unterschied zur Hepatitis B oder C ist die akute HIV-1 Infektion mit einer dramatischen Zytokinkaskade assoziiert. Bereits nach sieben Tagen kommt es zum rapiden Anstieg von Zytokinen der angeborenen Immunantwort mit folgender Hochregulierung von vielen anderen Zytokinen bei steigender Viruslast. Es ist anzunehmen, dass diese Zytokine, auch wenn sie teilweise zur Kontrolle der Infektion dienen, zum großen Teil auch zur Immunpathogenese beitragen (Stacey 2009). So konnte gezeigt werden, dass zytotoxische NK (natural killer)–Zellen während dieser Phase aktiviert sind und expandieren (Alter 2007). Obwohl während der akuten Phase nur selten gegen HIV gerichtete neutralisierende Antikörper gefunden werden, ist eine antikörperabhängige zellvermittelte Zytotoxizität nachzuweisen (Chung 2011), deren Rolle aber noch nicht erforscht ist. Darüberhinaus scheinen Marker auf CD4-Zellen in der akuten Infektion mit der Breite der neutralisierenden Immunantwort, die sich über die Jahre entwickelt, zusammenzuhängen (Mikell 2011). Dies spricht für eine wichtige Rolle der CD4-Zellen in der bislang nur wenig erforschten adaptiven Immunantwort gegen HIV.
Verschiedene Faktoren können die HIV-1 Replikation in der akuten Phase und somit auch den frühen viralen Setpoint beeinflussen. Hierzu gehört nicht nur die Replikationsfähigkeit („Viral Fitness“) des infizierenden Virus (Troyer 2009), sondern auch genetische Faktoren und die verschiedenen Arme der Immunantwort.
Die HIV-1-spezifische zelluläre Immunantwort nimmt eine Schlüsselstellung in der Kontrolle der HIV-Replikation ein: So steht der initiale Abfall der Virämie in engem zeitlichen Zusammenhang mit dem Erscheinen HIV-1-spezifischer CD8-T-Zellen (Koup 1994, Borrow 1994). Diese können HIV-1-infizierte Zellen direkt durch MHC-Klasse I-restringierte Zytolyse eliminieren oder indirekt durch die Produktion von Zytokinen, Chemokinen oder anderen löslichen Faktoren begrenzen (Yang 1997). Ein weiterer Hinweis auf die antivirale Aktivität HIV-1-spezifischer zytotoxischer T-Lymphozyten (CTL) während der akuten HIV-1-Infektion ist die rasche Selektion viraler Spezies mit Mutationen der CTL-Epitope. Diese unter Selektionsdruck entstehenden Spezies können schon wenige Wochen nach HIV-1- und SIV-Infektion in Menschen nachgewiesen werden (Price 1997); einige der CTL-Mutationen haben zudem einen starken Einfluss auf die virale Fitness. Dabei scheinen besonders die ersten CD8-T-Zellantworten aus der akuten HIV-1-Infektion einen effektiven Einfluss auf die virale Replikationsfähigkeit zu haben, da Patienten, die eine starke CTL-Antwort während der akuten HIV-1 Infektion haben, einen signifikant niedrigeren frühen viralen Setpoint haben (Streeck 2009). Dies gilt nicht für CD8-T-Zellantworten, die zu einem späteren Zeitpunkt während der chronischen HIV-Infektion aufkommen (Frahm 2004). Interessanterweise konnte eine Studie mit Peptiden, die genau der Sequenz des Virus in jeweiligem Patienten entsprachen (so genannte autologe HIV-1 peptide), zeigen, dass wahrscheinlich weit mehr Immunantworten zur initialen Kontrolle der Infektion beitragen (Goonetilleke 2009). Viele dieser frühen CTL-Antworten sind durch HLA-Klasse I-Allele restringiert, die sich günstig auf den weiteren Verlauf der Infektion auswirken, wie zum Beispiel HLA B57 oder HLA B27 (Altfeld 2006). Diese immunodominanten protektiven Immunantworten sind gegen Epitope gerichtet, die nicht weit verstreut über das HIV-1-Genom liegen, sondern in Clustern in einer definierten Region von p24 Gag auftreten (Streeck 2007), einer Region, die wichtig für die Stabilität des HIV-Kapsids zu sein scheint (Schneidewind 2007). Dass besonders die frühen CD8-T-Zellantworten effektiv in der Kontrolle der HIV-Replikation sind, kann an der Präsenz antigen-spezifischer CD4-T-Zellen liegen, die jedoch bevorzugt durch HIV infiziert werden und dadurch früh verloren gehen (Douek 2002).
Neben dem Verlust der HIV-spezifischen CD4-T-Zellen sind qualitative Einschränkungen der CD4-T-Zellfunktion charakteristisch, die bereits während der akuten Infektion zu beobachten sind (Rosenberg 1997, Lichterfeld 2004). Die Einschränkung und der Verlust der HIV-1-spezifischen CD4-T-Zellfunktion während der akuten Infektion können schließlich zu einer funktionellen Einschränkung der HIV-1-spezifischen CD8-T-Zellen führen (Lichterfeld 2004).
Die Rolle der CD4-Zellen für eine effektive HIV-spezifische CD8-T-Zellantwort ist nur unzureichend verstanden. Neuere Studien konnten jedoch zeigen, dass eine HIV-spezifische IL21-Sezernierung der CD4-Zellen die Effektivität der CD8-Zellantworten steigern kann (Chevalier 2010). Überdies zeigen Studien aus dem LCMV-Maus-Modell, dass für Entwicklung und Erhalt einer langlebigen CD8-Gedächtniszellantwort die Präsenz von CD4-T-Helferzellen bereits während der ersten Stunden der Generation neuer CD8-T-Zellantworten notwendig ist (Janssen 2003, Williams 2006). Bisher ist jedoch nicht genau bekannt, welche Signale der CD4-T-Zellen für den Erhalt HIV-spezifischer CD8-T-Zellen notwendig sind. Die im Verlauf nachlassende Funktionalität und Effektivität der CD8-T‑Zellen steht zu einem gewissen Grad in einem direkten Zusammenhang mit der Höhe der Viruslast.
Im LCMV-Mausmodell konnte auch gezeigt werden, dass CD8-T‑Zellen im Verlauf nach und nach verschiedene wichtige Funktionen einbüßen. Zuerst geht die Fähigkeit verloren, Interleukin-2 zu produzieren, gefolgt von der Fähigkeit zu proliferieren und der zytotoxischen Aktivität. Gleichzeitig scheint die Sensitivität für eine fas-induzierte Zellapoptose anzusteigen (Wherry 2004). Dieser graduell ablaufende Funktionsverlust konnte in indirekte Korrelation mit der Expression inhibitorischer Rezeptoren gesetzt werden, wie zum Beispiel programmed death-1 (PD-1) (Day 2006, Trautman 2006), das auf den HIV-spezifischen CD8-T-Zellen heraufreguliert ist. Die Bedeutung der Identifikation solcher Rezeptoren mag in der Erforschung möglicher Immuntherapien liegen, die zum Beispiel über eine Blockade dieser Rezeptoren das körpereigene Immunsystem gegen HIV reaktivieren.
Neben der Immunantwort des Wirts spielen auch genetische Faktoren eine wichtige Rolle, und zwar sowohl für Suszeptibilität und Resistenz gegen die HIV-1-Infektion als auch für die Geschwindigkeit der Krankheitsprogression. Der bedeutendste dieser Faktoren ist eine Deletion am Gen des wichtigsten Korezeptors für den Eintritt von HIV-1 in die CD4-T-Zelle, dem CCR5-Chemokin-Rezeptor (siehe Kapitel Grundlagen und im ART-Kapitel den Abschnitt Korezeptorantagonisten).
Neben Mutationen an Chemokin-Rezeptor-Genen wurden mehrere HLA-Klasse I-Allele sowohl mit niedrigeren viralen Setpoints als auch mit langsamerer Krankheitsprogression assoziiert, wie z. B. HLA B27 und B57 (O’Brien 1997, Kaslow 1996). Patienten, die diese Allele exprimieren, haben eine starke antivirale CTL-Immunantwort gegen eine bestimmte Region in p24 Gag und können wahrscheinlich dadurch die virale Replikation besser als andere kontrollieren (Altfeld 2006, Streeck 2007). Im Gegensatz dazu zeigen Patienten, die eine bestimmte Isoform von HLA B35 exprimieren (HLA B35px oder HLA B3502/HLA B3503), einen erheblich schnelleren Krankheitsverlauf. Die Ursache für diesen Unterschied ist bisher nicht geklärt.
Weiterhin konnte gezeigt werden, dass bestimmte killer-immunoglobulin-like Rezeptoren (kurz: KIR), die vornehmlich auf NK-Zellen, aber auch auf T-Zellen exprimiert werden, in Kombination mit einer Gruppe von HLA-B-Allelen (Bw4-80I) ebenfalls einen signifikant langsameren Progressionsverlauf haben (Martin 2002, Martin 2007), was auf eine Rolle der NK-Zellen in der HIV-Immunpathogenese hindeuten kann.
Diese Daten legen somit nahe, dass genetische Wirtsfaktoren die klinische Manifestation der akuten HIV-1-Infektion beeinflussen können. Wirtsfaktoren sind damit wichtige Determinanten für den späteren viralen Setpoint und die Geschwindigkeit der Krankheitsprogression.
Therapie
Die möglichen Ziele einer antiretroviralen Behandlung der akuten HIV-1-Infektion sind: die symptomatische Phase zu verkürzen und zu mildern, die Anzahl infizierter Zellen zu verringern, HIV-1-spezifische Immunantworten zu erhalten und möglicherweise langfristig den viralen Setpoint zu erniedrigen. Mehrere Studien haben in den letzten Jahren gezeigt, dass die Behandlung der akuten HIV-1-Infektion eine langfristige Virussuppression erlaubt, die HIV-1-spezifischen T-Helferzell-Antworten erhält bzw. sogar stärkt und letztlich eine sehr homogene Viruspopulation konserviert. Die klinische Relevanz dieser Effekte ist allerdings weiterhin unklar.
Pilotstudien an Patienten, die während der akuten HIV-1-Infektion behandelt wurden und anschließend strukturierte Therapiepausen unternahmen, zeigen, dass die meisten Patienten zumindest eine temporäre Kontrolle der Virusreplikation erreichen (Rosenberg 2000, Vogel 2006). Allerdings kommt es meist im weiteren Verlauf zu einem Wiederanstieg der Viruslast (Markowitz 1999, Kaufmann 2004). In einer prospektiven Studie von Patienten, die sich noch während der akuten Infektion für (n=12) oder gegen (n=8) eine 24-wöchige ART entschieden hatten, war die Viruslast 24 Wochen nach Therapieende zwischen beiden Gruppen nicht unterschiedlich (Streeck 2006).
Im Gegensatz dazu stehen die Resultate einer retrospektiven Studie, in der 337 unbehandelte mit 58 behandelten Patienten verglichen wurden. Letztere hatten entweder (n=13) noch in der akuten Infektionsphase oder während der ersten 6 Monate nach Infektion (n=45) mit einer ART begonnen. In dieser Studie hatte die frühe Behandlungsgruppe nach 24 Wochen höhere CD4-Zellzahlen und eine geringere Viruslast, einige Patienten auch noch nach 72 Wochen (Hecht 2006). Beide Studien haben Schwächen. In der ersten prospektiven und nicht-randomisierten Studie war die Teilnehmerzahl klein, in der großen, retrospektiven Studie waren Behandlungsdauer und Regime sehr variabel (Kinloch-de Loes 2006). Eine weitere Studie zeigte kürzlich ebenfalls einen Vorteil für eine Therapie während der akuten HIV Infektion (Grijsen 2011). Allerdings wurde auch hier den Patienten die Entscheidung für oder gegen eine Therapie freigestellt. Da die Schwere der Symptomatik stark von der Viruslast abhängt, beantwortet daher auch diese Studie nicht die Frage, ob eine Therapie in den ersten Wochen der akuten Infektion sinnvoll ist.
Es ist daher eine randomisierte Studie notwendig, um den Nutzen einer frühen ART bei akut infizierten Patienten zu klären. Angesichts der noch offenen Fragen sollten Patienten mit akuter HIV-1-Infektion in kontrollierten Studien behandelt werden. Falls dies nicht möglich ist, sollte die Option einer First-Line-Standardtherapie angeboten und diskutiert werden. Es ist wichtig, die Patienten aufzuklären über
- die mangelnde Datenlage zum klinischen Benefit einer frühen ART
- die Risiken der antiretroviralen Therapie und Therapiepausen
- Medikamententoxizität und Resistenzentwicklung
- das akute retrovirale Syndrom während des Wiederanstiegs der Viruslast
- mögliche HIV-Übertragung/Superinfektion während Therapiepausen
Literatur
Alter G, Martin MP, Teigen T, et al. Differential natural killer cell-mediated inhibition of HIV-1 replication based on distinct KIR/HLA subtypes. J Exp Med 2007, 204:3027-3036.
Altfeld M, Kalife ET, Qi Y, et al. HLA alleles associated with delayed progression to AIDS contribute strongly to the initial CD8(+) T cell response against HIV-1. PLoS Med 2006, 3:e403.
Altfeld M, Addo MM, Rosenberg ES, et al. Influence of HLA-B57 on clinical presentation and viral control during acute HIV-1 infection. AIDS. 2003, 17:2581-91.
Borrow P, Lewicki H, Hahn BH, Shaw GM, Oldstone MB. Virus-specific CD8+ cytotoxic T-lymphocyte activity associated with control of viremia in primary human immunodeficiency virus type 1 infection. J Virol 1994, 68:6103-6110.
Brenner BG, Roger M, Routy JP, et al. High rates of forward transmission events after acute/early HIV-1 infection. J Infect Dis 2007, 195:951-959.
Chung AW, Navis M, Isitman G, et al. Activation of NK Cells by ADCC Responses During Early HIV Infection. Viral Immunol 2011, 24:171-5.
Chevalier MF, Jülg B, Pyo A, et al. HIV-1-specific interleukin-21+ CD4+ T cell responses contribute to durable viral control through the modulation of HIV-specific CD8+ T cell function. J Virol 2011, 85:733-41.
Cooper DA, Gold J, Maclean P, et al. Acute AIDS retrovirus infection. Definition of a clinical illness associated with seroconversion. Lancet 1985,1:537.
Daar ES, Little S, Pitt J, et al. Diagnosis of primary HIV-1 infection. Ann Intern Med 2001,134:25-29.
Day CL, Kaufmann DE, Kiepiela P, et al. PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression. Nature 2006, 443:350-354.
DHHS of Health and Human Services. November 3, 2008; 1-139. Available at http://www.aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf.
Douek DC, Brenchley JM, Betts MR, et al. HIV preferentially infects HIV-specific CD4+ T cells. Nature 2002, 417:95-98.
Fiebig EW, Wright DJ, Rawal BD, et al. Dynamics of HIV viremia and antibody seroconversion in plasma donors: implications for diagnosis and staging of primary HIV infection. AIDS 2003; 17:1871-9.
Frahm N, Korber BT, Adams CM, et al. Consistent cytotoxic-T-lymphocyte targeting of immunodominant regions in human immunodeficiency virus across multiple ethnicities. J Virol 2004, 78:2187-2200.
Goonetilleke N, Liu MK, Salazar-Gonzalez JF, Ferrari G, et al. The first T cell response to transmitted/founder virus contributes to the control of acute viremia in HIV-1 infection. J Exp Med.2009, 206:1253-72.
Gray C, Mlotshwa M, Riou C, et al. Human immunodeficiency virus-specific gamma interferon enzyme–linked immunospot assay responses targeting specific regions of the proteome during primary subtype c infection are poor predictors of the course of viremia and set point. J Virol 2009, 83:470-478.
Gupta KK. Acute immunosuppression with HIV seroconversion. N Engl J Med 1993,328:288-289.
Grijsen M, Steingrover R, Wit F, et al. An RCT comparing no treatment with 24 or 60 weeks of temporary ART during primary HIV infection. Abstract 161´, 18th CROI 2011, Boston.
Hecht FM, Busch MP, Rawal B, et al. Use of laboratory tests and clinical symptoms for identification of primary HIV infection. AIDS 2002,16:1119-1129.
Hecht FM, Wang L, Collier A, et al. A multicenter observational study of the potential benefits of initiating combination antiretroviral therapy during acute HIV infection. J Inf Dis 2006, 194:725-33.
Janssen EM, Lemmens EE, Wolfe T, et al. CD4+ T cells are required for secondary expansion and memory in CD8+ T lymphocytes. Nature 2003, 421:852-856.
Kahn JO, Walker BD. Acute human immunodeficiency virus type 1 infection. New England Journal of Medicine 1998, 339:33-39.
Kaslow RA, Carrington M, Apple R, et al. Influence of combinations of human major histocompatibility complex genes on the course of HIV-1 infection. Nat Med 1996, 2:405-411.
Kaufmann DE, Lichterfeld M, Altfeld M, et al. Limited durability of viral control following treated acute HIV infection. Plos Med 2004, 1:e36.
Keet IP, Krijnen P, Koot M, et al. Predictors of rapid progression to AIDS in HIV-1 seroconverters. AIDS 1993,7:51-57.
Kinloch-de Loes S. Treatment of acute HIV-1 infection: Is it coming of age? JID 2006, 194:721-4.
Koup RA, Safrit JT, Cao Y, et al. Temporal association of cellular immune responses with the initial control of viremia in primary human immunodeficiency virus type 1 syndrome. J Virol 1994,68:4650-4655.
Lichterfeld M, Kaufmann DE, Yu XG, et al. Loss of HIV-1-specific CD8+ T cell proliferation after acute HIV-1 infection and restoration by vaccine-induced HIV-1-specific CD4+ T cells. J Exp Med 2004, 200:701-12.
Ly TD, Ebel A, Faucher V, Fihman V, Laperche S. Could the new HIV combined p24 antigen and antibody assays replace p24 antigen specific assays? J Virol Methods 2007, 143:86-94.
Markowitz M, Vesanen M, Tenner-Racz K, et al. The effect of commencing combination antiretroviral therapy soon after human immunodeficiency virus type 1 infection on viral replication and antiviral immune responses. J Infect Dis 1999,179:527-537.
Martin MP, Qi Y, Gao X, et al. Innate partnership of HLA-B and KIR3DL1 subtypes against HIV-1. Nat Genet 2007, 39:733-740.
McMichael AJ, Borrow P, Tomaras GD, Goonetilleke N, Haynes BF. The immune response during acute HIV-1 infection: clues for vaccine development. Nat Rev Immunol 2010; 10:11-23.
Martin MP, Gao X, Lee JH, et al. Epistatic interaction between KIR3DS1 and HLA-B delays the progression to AIDS. Nat Genet 2002, 31:429-434.
Mellors JW, Kingsley LA, Rinaldo CR, et al. Quantitation of HIV-1 RNA in plasma predicts outcome after seroconversion. Ann Int Med 1995,122:573-9.
Mellors JW, Margolick JB, Phair JP, et al. Prognostic value of HIV-1 RNA, CD4 cell count, and CD4 cell count slope for progression to AIDS and death in untreated HIV-1 infection. JAMA 2007, 297:2349-2350.
Mikell I, Sather DN, Kalams SA, Altfeld M, Alter G, Stamatatos L.Characteristics of the earliest cross-neutralizing antibody response to HIV-1. PLoS Pathog 2011, 7:e1001251.
O’Brien SJ, Gao X, Carrington M. HLA and AIDS: a cautionary tale. Trends Mol Med 2001,7:379-381.
Pedersen C, Lindhardt BO, Jensen BL, et al. Clinical course of primary HIV infection: consequences for subsequent course of infection. BMJ 1989,299:154-157.
Price DA, Goulder PJ, Klenerman P, et al. Positive selection of HIV-1 cytotoxic T lymphocyte escape variants during primary infection. Proc Natl Acad Sci U S A 1997,94:1890-1895.
Rosenberg ES, Altfeld M, Poon SH, et al. Immune control of HIV-1 after early treatment of acute infection. Nature 2000,407:523-526.
Rosenberg ES, Billingsley JM, Caliendo AM, et al. Vigorous HIV-1-specific CD4+ T cell responses associated with control of viremia. Science 1997,278:1447-1450.
Schneidewind A, Brockman MA, Yang R, et al. Escape from the dominant HLA-B27-restricted cytotoxic T-lymphocyte response in Gag is associated with a dramatic reduction in HIV type 1 replication. J Virol 2007, 81:12382-12393.
Stacey AR, Norris PJ, Qin L, Haygreen et al. Induction of a striking systemic cytokine cascade prior to peak viremia in acute human immunodeficiency virus type 1 infection, in contrast to more modest and delayed responses in acute hepatitis B and C virus infections. J Virol 2009, 83:3719-33.
Streeck H, Jessen J, Alter G, et al. Immunological and virological impact of HAART initiated during acute HIV-1 infection. J Inf Dis 2006, 194:734-739.
Streeck H, Lichterfeld M, Alter G, et al. Recognition of a defined region within p24 gag by CD8+ T cells during primary HIV type 1 infection in individuals expressing protective HLA class I alleles. J Virol 2007, 81:7725-7731.
Streeck H, Jolin J, Qi Y, et al. HIV-1-specific CD8+ T cell responses during primary infection are major determinants of the viral set point and loss of CD4+ T cells. AIDS Vaccine Conference, October 2008, Cape Town 2008
Trautmann L, Janbazian L, Chomont N, et al. Upregulation of PD-1 expression on HIV-specific CD8+ T cells leads to reversible immune dysfunction. Nat Med 2006, 12:1198-1202.
Troyer RM, McNevin J, Liu Y, et al.. Variable fitness impact of HIV-1 escape mutations to cytotoxic T lymphocyte (CTL) response. PLoS Pathog 2009, 5:e1000365.
Vanhems P, Lambert J, Cooper DA, et al. Severity and prognosis of acute hiv type 1 illness: a dose-response relationship. Clin Inf Dis 1998, 26:323-9.
Vento S, Di Perri G, Garofano T, Concia E, Bassetti D. 1993. Pneumocystis carinii pneumonia during primary HIV-1 infection. Lancet 342:24-5
Vogel M, Lichterfeld M, Kaufmann DE. Structured treatment interruptions following immediate initiation of HAART in eight patients with acute HIV-1 seroconversion. Eur J Med Res 2006, 11:273-8.
Wherry EJ, Ahmed R. Memory CD8 T-cell differentiation during viral infection. J Virol 2004, 78:5535-5545.
Williams MA, Tyznik AJ, Bevan MJ. IL-2 signals during priming are required for secondary expansion of CD8+ memory T cells. Nature 2006, 441:890-3.
Yang OO, Kalams SA, Trocha A, et al. Suppression of human immunodeficiency virus type 1 replication by CD8+ cells: evidence for HLA class I-restricted triggering of cytolytic and noncytolytic mechanisms. J Virol 1997, 71:3120-8.